পৰমাণুৰ গঠন
প্ৰশ্নাৱলীঃ–
১। কেনেল ৰশ্মি কি ?
উত্তৰঃ ১৮৮৬ চনত ই গ’ল্ডষ্টেইনে (E.Goldstain) গেছৰ বিদ্যুত মোক্ষণত এবিধ নতুন বিকিৰণৰ উপস্থিতি ধৰা পেলাইছিল আৰু ইয়াকে কেনেল ৰশ্মি বোলা হৈছিল ।
২। পৰমাণু এটাত এটা প্ৰ’টন আৰু এটা ইলেকট্ৰ’ন থাকিলে ই কোনো আধান বহন কৰিবনে নকৰে ?
উত্তৰঃ নকৰে । কাৰণ পৰমাণু এটাত এটা প্ৰ’টন আৰু এটা ইলেকট্ৰন থাকিলে পৰমানুটো বৈদ্যুতিকভাৱে প্ৰশমিত অৱস্থাত থাকিব । পৰমাণুটো এটাত থকা প্ৰ’টন আৰু ইলেকট্ৰনৰ আধান সাধাৰণতে সমান আৰু পৰষ্পৰ বিপৰীত ধৰ্মী হৈ থাকে ।
৩। থমছনৰ পৰমাণুৰ আৰ্হিৰ মতে পৰমাণু এটা সামগ্রিকভাৱে কেনেদৰে প্ৰশম হয় ব্যখ্যা কৰা ।
উত্তৰঃ থমছনৰ পৰমাণু আৰ্হিৰ মতে- পৰমাণু এটা ধনাত্মক ভাৱে আহিত একোটা গোলক ইলেকট্ৰ’ন বোৰ ইয়াত সোমাই থাকে । লগতে কৈছিলে যে-ঋণাত্মক আৰু ধনাত্মক আধান সমান মানৰ । সেইবাবে পৰমাণু এটা বৈদ্যুতিক ভাৱে প্ৰশম ।
৪। ৰাডৰফ’ৰ্ডৰ পৰমাণুৰ আৰ্হিৰ মতে পৰমাণুৰ নিউক্লিয়াছত কোনটে উপ-পাৰমাণৱিক কণা থাকে ।
উত্তৰঃ ৰাডাফ’ৰ্ডৰ পৰমাণুৰ আৰ্হিৰ মতে পৰমাণুৰ নিউক্লিয়াছত থকা উপ-পাৰমাণৱিক কণাটো হ’ল প্ৰ’টন ।
৫। তিনিটা শ্বেলৰে সৈতে ব’ৰৰ পৰমাণুৰ আৰ্হিৰ এটা চিত্র অংকন কৰা ।
উত্তৰঃ
৬। যদি a – কণা বিচ্ছুৰণ পৰীক্ষাটোত সোণৰ পাতৰ সলনি আন ধাতুৰ পাত ব্যৱহাৰ কৰা হয় তেনেহ’লে কি দেখা যাব বুলি ভবা ?
উত্তৰঃ a-কণা বিচ্ছুৰণ পৰীক্ষাটোত সোণৰ পাতৰ সলনি বেলেগ ব্যৱহাৰ কৰিলেও ফলাফল একে হব । কাৰণ সকলো পৰমাণুৰ গঠন একে ।
৭) পৰমাণুৰ তিনিটা উপ-পাৰমাণৱিক কণাৰ নাম লিখা ।
উত্তৰঃ পৰমাণুৰ উপ-পাৰমানৱিক কণাকেইটা হ’ল -ইলেকট্ৰন, প্ৰ’টন আৰু নিউট্ৰন ।
৮। হিলিয়াম পৰমাণুৰ পাৰমাণিৱক ভৰ 4u আৰু ইয়াৰ নিউক্লিয়াছত দুটা প্ৰ’টন আছে । ইয়াত কিমানটা নিউট্ৰন থাকিব ?
উত্তৰঃ হিলিয়ামৰ পাৰমাণৱিক ভৰ 4u আৰু ইয়াত দুটা প্ৰটন নিউক্লিয়াছত থাকিলে , নিউট্ৰন ও দুটা থাকিব । কাৰণ নিউক্লিয়াছত প্ৰ’টন নিউক্লিয়াছত প্ৰ’টন আৰু নিউট্ৰনৰ সংখ্যা সমান থাকে ।
বা
পৰমাণু এটাৰ ভৰ পৰমাণুটোত থকা প্ৰটন আৰু নিউট্ৰনৰ ভৰৰ সমান আৰু পৰমাণুত প্ৰটন আৰু নিউট্ৰন সংখ্যা সমান সমান থাকে। যিহেতু প্ৰটন দুটা আছে গতিকে, নিউট্ৰনো দুটা থাকিব।
৯। কাৰ্বন আৰু ছডিয়াম পৰমাণুত ইলেকট্ৰনৰ বিতৰণ দেখুওৱা ।
উত্তৰঃ কাৰ্বনৰ পৰমাণু ক্ৰমাংক= 6 । গতিকে কাৰ্বন পৰমাণুত প্ৰ’টন আৰু ইলেকট্ৰনৰ সংখ্যাক ক্ৰমে 6 আৰু 6 হব ।
এতেকে কাৰ্বনৰ প্ৰথম শ্বেলত থাকিব= 2 টা ইলেকট্ৰন
দ্বিতীয় শ্বেলত থাকিব= 4 টা ইলেকট্ৰন
গতিকে e ৰ ইলেকট্ৰনীয় বিন্যাস হব = 2. 4
ছডিয়াম (Na)ৰ পৰমাণু ক্ৰমাংক = 11 গতিকে ইয়াৰ প্ৰ’টন সংখ্যা 11 আৰু ইলেকট্ৰন সংখ্যা 11 ।
এতেকে Naৰ প্ৰথম শ্বেলত ইলেকট্ৰন থাকিব = 2
Naৰ দ্বিতীয় শ্বেলত ইলেকট্ৰন থাকিব = 8
Naৰ তৃতীয় শ্বেলত ইলেকট্ৰন থাকিব = 1
গতিকে Naৰ ইলেকট্ৰনীয় বিন্যাস হব = 2.8.1 ।
১০। পৰমাণু এটাৰ K আৰু L শ্বেলবোৰ পূৰ্ণ হৈ থাকিলে পৰমাণুটোত ইলেকট্ৰনৰ মুঠ সংখ্যা কিমান হ’ব ?
উত্তৰঃ পৰমাণু এটাৰ প্ৰথম কক্ষ অৰ্থাৎ K শ্বেলত থাকিব পৰা ইলেকট্ৰনৰ সৰ্বোচ্ছ সংখ্যা হ’ল = 2
আকৌ দ্বিতীয় কক্ষপথ বা L শ্বেলত থাকিব পৰা ইলেকট্ৰনৰ সৰ্বোচ্ছ সংখ্যা হ’ল = 8
গতিকে দুয়োটা শ্বেল পূৰ্ণ হৈ থাকিলে ইলেকট্ৰনৰ মুঠ সংখ্যা হব (K+L) = 2+8
= 10
১১। ক্ল’ৰিণ , ছালফাৰ আৰু মেগনেছিয়ামৰ যোজ্যতা কেনেদৰে পাবা ?
উত্তৰঃ ক্ল’ৰিণৰ (a) ইলেকট্ৰনীয় বিন্যাস হ’ল = 2.8.7 ।
ইয়াৰ বহিঃখোলৰ অ’কটেট পূৰ্ণ কৰিবলৈ 1 টা ইলেকট্ৰনৰ প্ৰয়োজন । গতিকে ইয়াৰ যোজ্যতা = 1 ।
ছালফাৰ (s)ৰ ইলেকট্ৰনীয় বিন্যাস হ’ল = 2.8.7 ।
ছালফাৰৰ বহিঃকক্ষৰ অ’কটেট পূৰ্ণ কৰিবলৈ 2 টা ইলেকট্ৰনৰ দৰকাৰ ।গতিকে ইয়াৰ যোজ্যতা = 2
মেগনেছিয়াম (Mg) ৰ ইলেকট্ৰনীয় বিন্যাস = 2.8.2 ।
ইয়াৰ বহিঃখোলাৰ অ’কটেট হ’বলৈ 2 টা ইলেকট্ৰন ত্যাগ কৰিব লাগিব । গতিকে ইয়াৰ যোজ্যতা = 2
১২। যদি পৰমাণু এটাত ইলেকট্ৰনৰ সংখ্যা 8 আৰু প্ৰ’টনৰ সংখ্যাও 8 হয় তেন্তে (i) পৰমাণুটোৰ পাৰমাণৱিক সংখ্যা কি হ’ব ?আৰু (ii) পৰমাণুটোৰ আধান কিমান হ’ব ?
উত্তৰঃ (i) পৰমাণুটোৰ পাৰমাণৱিক সংখ্যা হব = 8 ।
(ii) পৰমাণুটো আধানহীন হব । কাৰণ তাত প্ৰ’টন আৰু ইলেকট্ৰনৰ সংখ্যা সমান সমান হব । গতিকে ই বৈদ্যুতিকভাৱে প্ৰশম অৱস্থাত থাকিব ।
অনুশীলনী
১। ইলেকট্রন , প্র’টন আৰু নিউট্রনৰ ধর্মসমূহ তুলনা কৰা ।
উত্তৰঃ ইলেকট্ৰন,প্ৰ’টন আৰু নিউট্ৰনৰ ধৰ্মসমূহ তলত আলোচনা কৰা হল-
| ধৰ্মসমূহ | ইলেকট্ৰন | প্ৰ’টন | নিউট্ৰন |
| আধান | ঋণাত্মক আধান | ধনাত্মক আধান | কোনো আধান নাই |
| অৱস্থান | নিউক্লিয়াছৰ চাৰিওফালে নিৰ্দিষ্ট কক্ষপথত ঘুৰি থাকে । | নিউক্লিয়াছত থাকে । | পৰমাণুৰ নিউক্লিয়া-ছত থাকে |
| ওজন | একেবাৰে নগন্য | 1 a.m.u | 1 a.m.u |
২। জে জে থমছনৰ পৰমাণুৰ আৰ্হিৰ সীমাবদ্ধতাসমূহ কি কি ?
উত্তৰঃ জে জে থমছনত আৰ্হিয়ে পৰমাণু এটা যে বৈদ্যুতিক ভাৱে প্ৰশমঅক বাখ্যা কৰিব পাৰিলে আন বহুতো কথা তেওঁ বাখ্যা কৰিব নোৱাৰিলে । তলত আমি আলোচনা কৰিম যে জে জে থমছনৰ পৰীক্ষাই কোনবোৰ কথা বাখ্যা কৰিব নোৱাৰিলে ।
১। ইলেকট্ৰনৰ অৱস্থিতি অৰ্থাৎ ইলেকট্ৰনবোৰ যে কিছুমান নিৰ্দিষ্ট কক্ষপথ বা শক্তিস্তৰত থাকে সেই কথা উল্লেখ নকৰিলে ।
২। পৰমাণু এটাৰ বেছিভাগ ঠাই খালী ।
৩। প্ৰ’টন বা ধনাত্মক আধানবোৰ পৰমাণুৰ কেন্দ্ৰত থুপ হৈ তাকে সেই কথাও বাখ্যা কৰিব নোৱাৰিলে ।
৪। নিউট্ৰন অৱকণিকাৰ অৱস্থান ।
৫। মৌলৰ সমস্থানিক সমভাৰী আৰু যোজ্যতা ৰ ওপৰতও একো বাখ্যা কৰিব নোৱাৰিলে ।
৩। ৰাডাৰ ফ’ৰ্ডৰ পৰমাণুৰ আৰ্হিৰ সীমাবদ্ধতাসমূহ কি কি ?
উত্তৰঃ আমি জানো যে পৰমাণুসমূহ সূস্থিৰ । কিন্তু ৰাডাৰ ফ’ৰ্ডে পৰমাণুৰ সুস্থিৰতা একো বাখ্যা কৰিব নোৱাৰিলে ।
তেঁওৰ মতে ইলেকট্ৰ’নবোৰ কিছুমান কক্ষপথত নিউক্লিয়াছৰ চাৰিওফালে ঘূৰি থাকে । কিন্তু বৃত্তকাৰ কক্ষপথত ইলেকট্ৰনৰ পৰিভ্ৰমণ সুস্থিৰ হোৱাটো আশা কৰা নাযায় । বৃত্তকাৰ কক্ষপথত যিকোনো কণাৰ ত্বৰণ ঘটে । ত্বৰণৰ সময়ত আধানমুক্ত কণাই শক্তি বিকিৰণ কৰে । এনেদৰে ঘূৰ্ণায়মান ইলেকট্ৰনে শক্তি হেৰুবাব আৰু শেষত নিউক্লিয়াছত পতিত হ’ব । এইটোৱে হোৱা হ’লে পৰমাণু অতিশয় অশান্ত হ’লহেতেন আৰু আমি যি ৰূপত পদাৰ্থক জানো তেনে ৰূপত পদাৰ্থ নাথাকিলেহেঁতেন ।
৪। ব’ৰৰ পৰমাণুৰ আৰ্হিটো বর্ণনা কৰা ।
উত্তৰঃ (i) পৰমাণুৰ ভিতৰত ইলেকট্ৰ’নৰ কিছুমান নিৰ্দিষ্ট অনুমোদিত কক্ষপথ হৈ থাকে ।
(ii) এই কক্ষপথবোৰত গূৰি থাকোতে ইলেকট্ৰ’নে শক্তি বিকিৰণ নকৰে । এইকক্ষপথ বা শ্বেলবোৰক শক্তিস্তৰ বোলা হয় ।
(iii) নিৰ্দিষ্ট কক্ষপথ এটাত ঘুৰি থাকোতে ইলসেকট্ৰন এটাত নিৰ্দিষ্ট পৰিমাণৰ শক্তি নিহিত হৈ থাকে । গতিকে স্থিৰ কক্ষপথ এটা ঘূৰি থকা অৱস্থাত ইলেকট্ৰ’ন এটাই শক্তিৰ অৱশোষণ বা বিকিৰণ নকৰে ।
(iv) এটা কক্ষপথৰ পৰা অন্য এটা কক্ষপথলৈ ইলেকষ্ট্ৰন এটাই জপিয়ালে নিৰ্দিষ্ট পৰিমাণৰ শক্তি অৱশোষণ বা বিকিৰণ হয় ।
৫।এই অধ্যায়ত দিয়া পৰমাণুৰ আৰ্হি কেইটা তুলনা কৰা ।
উত্তৰঃ জে জে থমছনৰ পৰমাণুৰ আৰ্হিত, পৰমাণু য়ে বৈদ্যুতিক ভাৱে প্ৰশম অৱস্থাত থাকে তাকে বাখ্যা কৰৰিছিল । কিন্তু পৰমাণু গঠনৰ অন্য ধৰ্ম বাখ্যা কৰিব পৰা নাছিল ।
ৰাডাৰফৰ্ডৰ আৰ্হিত পৰমাণু ভতৰভাগৰ বেছি অংশই খালী আৰু ধনাত্মক অংশ কেন্দ্ৰত থুপ হৈ থাকে বুলি বাখ্যা কৰিলেও তেওঁ পৰমাণুৰ সুস্থিৰতা বাখ্যা কৰিব নোৱাৰিলে । তেওঁৰ মতে ইলেকট্ৰ’নবোৰ নিউক্লিয়াছৰ চাৰিওফালে ঘুৰি থাকে বুলি কৈছিল যদিও সেইটো বাস্তৱত সম্ভৱ নহয়। নীল ব’ৰৰ পৰমাণু আহিত ইলেকট্ৰ’নৰ শক্তি স্তৰ সঠিক বাখ্যা আগবঢোৱা হৈছিল আৰু আগৰ আৰ্হিৰ আসোঁৱাহ সমূহ আতৰ হৈছিল ।
৬। প্রথম ওঠৰটা মৌলৰ কাৰণে বিভিন্ন শ্বেলত ইলেকট্রন বন্টনৰ নিয়মবােৰ সংক্ষেপে লিখা ।
উত্তৰঃ পৰমাণুৰ বেলেগ বেলেগ কক্ষপথত ইলেকট্ৰনৰ বন্টৰ কেনে হ’ব তলত বাখ্যা কৰা হ’ল-
বেলেগ বেলেগ শক্তিস্তৰত বাশ্বেলত ইলেকট্ৰনৰ সংখ্যা লিখোতে এই নিয়মবোৰ মনা হয়-

(ii) পৰমাণুৰ বহিৰতম কক্ষপথত থাকিবপৰা ইলেকট্ৰনৰ সৰ্বোচ্ছ সংখ্যা=8
(iii) ভিতৰত নিম্নতৰ শক্তি শ্বেলবোৰ পূৰ্ণ নোহোৱা পৰ্যন্ত এটা নিৰ্দিষ্ট শ্বেলত ইলেকট্ৰন সোমাব নোৱাৰে। অৰ্থাৎ শ্বেলবোৰ ক্ৰমশঃ ইহঁতৰ শক্তিক্ৰম অনুযায়ী পূৰ্ণ হয় ।
প্ৰথম ওঠৰটা মৌলৰ কাৰণে বিভিন্ন শ্বেলত ইলেকট্ৰন বন্টন কেনে হব তলত দিয়া হ’ল-

৫১ নাম্বাৰ পৃষ্ঠাত থকা তালিকাঃ4.1 খন চালে হ’ল
৭। ছিলিকন আৰু অক্সিজেনক উদাহৰণ হিচাপে লৈ যােজ্যতাৰ সংজ্ঞা দিয়া ।
উত্তৰঃ ছিলিকনৰ পৰমাণৱিক সংখ্যা 14 । ইয়াৰ ইলেকট্ৰনৰ বিন্যাস হব2,8,4 অৰ্থাৎ বন্টন K=2,L=8,M=4 । ইয়াৰ পৰা দেখা গ’ল ইয়াৰ বহিঃকক্ষত 4 টা ইলেকট্ৰন ত্যাগ বা গ্ৰহণ কৰিব লাগিব । কিন্তু ছিলিকনে 4 টা ইলেকট্ৰন অন্য পৰমাণুৰ যোজ্যতা ইলেকট্ৰনৰ লগত সহযোগিতা বা সমভাগ কৰে । গতিকে ছিলিকনৰ যোজ্যতা 4 ।
অক্সিজেনৰ পাৰমাণৱিক সংখ্যা 8 । ইয়াৰ ইলেকট্ৰনৰ বন্টন K=2,L=6 । অৰ্থাৎ বহিঃ খোলত 6 টা যোজ্যতা ইলেকট্ৰন ই গ্ৰহণ কৰিব লাগিব । গতিকে অক্সিজেনৰ যোজ্যতা 2 ।
অৰ্থাৎ মৌলৰ পৰমাণুৰ বহিঃশ্বেলত অকটেট পূৰ্ণ কৰিবলৈ যিমানটো ইলেকট্ৰন গ্ৰহণ কৰে বা ত্যাগ কৰে তাকে মৌলটোৰ যোজ্যতা বোলা হয় ।
৮। উদাহৰণৰে সৈতে ব্যাখ্যা কৰা –
( i ) পাৰমাণবিক সংখ্যা ( ii ) ভৰ সংখ্যা ( iii ) সমস্থানিক আৰু ( iv ) সমভাৰী ।সমস্থানিকৰ যিকােনো দুটা ব্যবহাৰ লিখা ।
উত্তৰঃ (i) পৰমাণৱিক সংখ্যাঃ মৌলৰ পৰমাণুত থকা প্ৰ’টনৰ সংখ্যাক তাৰ পাৰমাণৱিক সংখ্যা বোলে ।
যেনেঃ (a) হাইড্ৰজেনৰ প্ৰ’টন 1টা, গতিকে পাৰমাণৱিক সংখ্যা 1
(b) অক্সিজেনৰ প্ৰ’টন 8টা, গতিকে পাৰমাণৱিক সংখ্যা 8
(c) কাৰ্বনৰ প্ৰ’টন 6টা, গতিকে পাৰমাণৱিকসংখ্যা 6
(ii) ভৰ সংখ্যাঃ মৌলৰ পৰমাণুত থকা প্ৰ’টন আৰু নিউট্ৰনৰ মুঠ সংখ্যাক ভৰসংখ্যা বোলে ।
উদাহৰণস্বৰূপে, কাৰ্বনৰ ভৰ 12u কাৰণ ইয়াৰ পৰমাণুকেন্দ্ৰত 6টা প্ৰ’টন আৰু 6টা নিউট্ৰন থাকে ,6u+6u=12u
একেদৰে, এলুমিনিয়ামৰ ভৰ 27u
কাৰণ ইয়াৰ পৰমাণুকেন্দ্ৰত 13প্ৰ’টন আৰু 14 নিউট্ৰন থাকে, 13u+14u=27u
(iii) সমস্থানিকঃ একেবিধ মৌলৰ একে পৰামাণৱিক সংখ্যাবিশিষ্ট কিন্তু ভিন ভিন ভৰৰ সংখ্যাযুক্ত পৰমাণুসমূহক সমস্থানিক বোলা হয় ।
যেনেঃ হাইড্ৰজেনৰ তিনিবিধ পৰমাণু আছে । প্ৰ’টিয়াম, ডয়টেৰিয়াম আৰু ট্ৰিটিয়াম ।
প্ৰতিটো পৰমাণৱিক সংখ্যা একে, কিন্তু ভৰ সংখ্যা ক্ৰমে 1,2,3 ।
(iv) সমভাৰীঃ বেলেগ বেলেগ পাৰমাণৱিক সংখ্যা বিশিষ্ট কিন্তু একে ভৰ সংখ্যাযুক্ত বেলেগ বেলেগ মৌলৰ পৰমাণুবোৰক সমভাৰী বোলা হয় ।
যেনে- Caৰ পাৰমাণৱিক সংখ্যা 20, ভৰ সংখ্যা 40
Ar ৰ পাৰমাণৱিক সংখ্যা 18, ভৰ সংখ্যা 40
এতেকে Ca আৰু Ar সমভাৰী মৌল ।
সমস্থানিকৰ দুটা ব্যৱহাৰ হল-
(i) ইউৰেনিয়ামৰ এটা সমস্থানিক নিউক্লীয় ৰিয়েষ্টৰত ইন্ধন হিচাপে ব্যৱহাৰ হয় ।
(ii) ক’ৰান্টৰ এটা সমস্থানিক কৰ্কটৰোগৰ চিকিৎসাত ব্যৱহাৰ কৰা হয় ।
৯। Na+ ত সম্পূৰূপে পূৰ হৈ থকা K আৰু L শ্বেল আছে । বাখ্যা কৰা ।
উত্তৰঃ
পৰমাণুৰ গঠনত নীল ব’ৰৰ আৰ্হিমতে তাৰ বিভিন্ন শ্বেলত ইলেকট্ৰন বন্টন হ’ল-
K=2, L=8, M=18, N=32
আনহাতে পৰমাণুৰ বহিঃকক্ষত থাকিব পৰা ইলেকট্ৰনৰ সংখ্যা 8 ।
Na+ ৰ ইলেকট্ৰনৰ সংখ্য়া হ’ল=10, গতিকে ইলেকট্ৰনবন্টন K=2, L=8
অৰ্থাৎ K আৰু L শ্বেল সম্পূৰ্ণৰূপে পূৰ্ণ হৈ আছে ।

উত্তৰঃ Br পৰমাণুৰ গড় পাৰমাণৱিক ভৰ হব-


উত্তৰঃ

১২। যদি Z=3হয়, তেন্তে মৌলৰটোৰ যৌজ্যতা কিমান হ’ব ? মৌলটোৰ নাম লিখা ।
উত্তৰঃ Z=3 মানে মৌলটোৰ পাৰমাণৱিক সংখ্যা=3
গতিকে মৌলটোৰ যোজ্যতা হ’ব = 1 আৰু মৌলটো হব লিখিয়াম (Li)
১৩। দুটা পৰমাণু X আৰু Yৰ নিউক্লিয়াছৰ সংযুক্তি তলত দিয়া হৈছে ।
X Y
প্ৰ’টন= 6 6
নিউট্ৰন= 6 8
X আৰু Yৰ ভৰ সংখ্যা দিয়া । দুয়োটাৰ মাজৰ সম্পৰ্কটো কি ?
উত্তৰঃ X মৌলৰ ভৰ সংখ্যা= 6+6 = 12
Y মৌলৰ ভৰ সংখ্যা = 6+8 =14
X আৰু Y দুয়োটা মৌলৰ পাৰমাণৱিক সংখ্যা একে কিন্তু ভৰ সংখ্যা বেলেগ বেলেগ । গতিকে মৌল দুটা সমস্থানিক ।
১৪। তলৰ শুদ্ধ উক্তিবোৰৰ ঠাইত T আৰু ভূলবোৰৰ ঠাইত F লিখা ।
(a) জে জে থমছনে প্ৰস্তা কৰিছিল যে পৰমাণুৰ নিউক্লিয়াছত কেৱল নিউক্লিয়ন থাকে ।
উত্তৰঃ F
(b) ইলেকট্ৰন এটা আৰু প্ৰ’টন এটা লগ লাগি নিউট্ৰন এটা গঠন হয় । সেইবাবে ই প্ৰশম ।
উত্তৰঃ F
(c) ইলেকট্ৰন এটাৰ ভৰ প্ৰ’টনৰ ভৰৰ প্ৰায় ।
উত্তৰঃ T
(d) আয়ডিনৰ এটা সমস্থানিক টিংচাৰ আয়ড়িন প্ৰস্তুত কৰাত ব্যৱহাৰ কৰা হয়, টিংচাৰ আয়ডিন মেডিচিন হিচাপে ব্যৱহাৰ কৰা হয় ।
উত্তৰঃ F
প্ৰশ্নঃ 15,16,আৰু 17 ত শুদ্ধ বাচনিৰ বিপৰীতে টিক (✓) চিন আৰু ভুল বচনিৰ বিপৰীতে ক্ৰচ (❌) চিন দিয়া ।
১৫। ৰাডাৰ ফ’ডৰ আলফা কণা বিচ্ছুৰণ পৰীক্ষাই –
(a) পাৰমাণৱিক নিউক্লিয়াছ (b) ইলেকট্ৰন
(c) প্ৰ’টন (d) নিউট্ৰন
আৱিষ্কাৰ কৰিছিল
উত্তৰঃ (a) পাৰমাণৱিক নিউক্লিয়াছ
১৬। মৌল এটাৰ সমস্থানিকবোৰৰ
(a) একে ভৌতিক ধৰ্ম
(a) ভিন্ন ৰাসায়নিক ধৰ্ম
(a) ভিন্ন সংখ্যক নিউট্ৰন
(a) ভিন্ন পাৰমাণৱিক সংখ্যা থাকে ।
উত্তৰঃ (a) ভিন্ন সংখ্যক নিউট্ৰন
১৭। CI-আয়নত যোজ্যতা ইলেকট্ৰনৰ সংখ্যা
(a) 16 (b) 8 (c) 17 (d) 18
উত্তৰঃ (b) 8
১৮। তলৰ কোনটো ছ’ডিয়ামৰ শুদ্ধ ইলেকট্ৰনীয় বিন্যাস ?
(a) 2,8 (a) 8,2,1 (a) 2,1,8 (a) 2,8,1
উত্তৰঃ (a) 2,8,1
১৯। তলৰ তালিকা খন সম্পূৰ্ণ কৰা ।
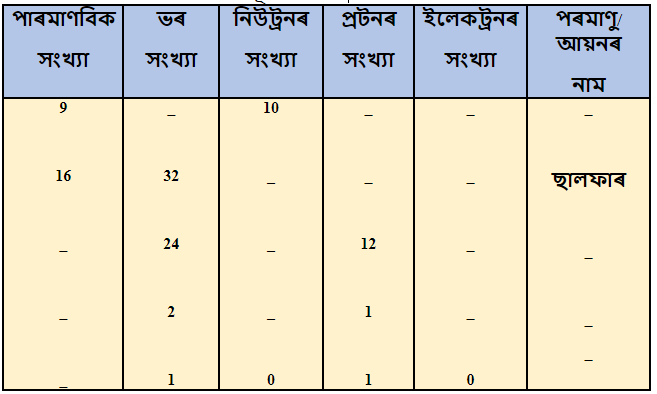
উত্তৰঃ
| পাৰমাৱিক সংখ্যা | ভৰ সংখ্যা | নিউট্ৰনৰ সংখ্যা | প্ৰ’টনৰ সংখ্যা | ইলেকট্ৰনৰ সংখ্যা | পৰমাণু\আয়নৰ সংখ্যা |
| 9 16 12 1 | 19 32 24 2 1 | 10 16 12 1 0 | 9 16 12 1 1 | 9 16 12 1 0 | ক্লুৰিণ ছালফাৰ মেগমেছিয়াম হাইড্ৰ’ডেন ডয়টেৰিয়াম হাইড্ৰজেন |